| 상하이 생화학·세포생물학연구소, 척수소뇌성 실조증 7형 병원성 단백질의 메커니즘 | ||
|
||
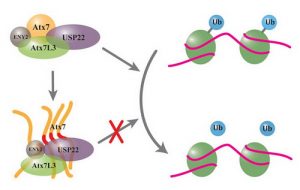 최근, 중국과학원 상하이(上海)생명과학원 생화학·세포생물학연구소 후훙위(胡紅雨) 연구팀은 척수소뇌성 실조증 7형 단백질(Ataxin-7)이 특이한 상호작용을 통하여 탈유비퀴틴화 효소 USP22를 운반함으로써 그 기능을 손상시킨다는 것을 발견하였다. 해당 연구는 척수소뇌성 실조증 7형 단백질의 새로운 발병 메커니즘을 제시하였으며, 단백질 축적으로 인한 세포독성과 신경 퇴행성을 해석함으로써, 해당 연구팀이 기존에 제안한 운반 모델을 검증하는데 새로운 실험 증거를 제공하였다. 해당 연구논문 “Aggregation of Polyglutamine-Expanded Ataxin-7 Specifically Sequesters Ubiquitin-Specific Protease 22 and Deteriorates Its Deubiquitinating Function in SAGA Complex”은 2015년 9월 4일 “The Journal of Biological Chemistry”에 온라인으로 발표되었다. 척수소뇌성 실조증 7형(Spinocerebellar Ataxia 7,SCA7)은 Ataxin-7 단백질의 폴리글루타민(Polyglutamine, PolyQ)영역의 비정상적인 확장으로 인한 신경 퇴행성 질환이다. 척수소뇌성 실조증 환자는 보행 장애, 손 민첩성 저하, 언어 장애 및 실명 등 임상 증상을 보인다. 전사 공활성화 인자 SAGA 복합물의 서브유닛인 Ataxin-7 단백질의 PolyQ 확장으로 인하여 오접힘(misfolding)이 발생할 수 있으며, 또 축적물 혹은 봉입체가 형성될 수 있다. 해당 축적물 혹은 봉입체가 SGAG 복합물의 기능에 영향을 미치는지는 아직 알려지지 않았다. 연구팀은 PolyQ이 비정상적으로 확장된 Ataxin-7은 SAGA 복합물 중 중요한 탈유비퀴틴화 효소USP22를 불용성 축적물 혹은 봉입체에 집합시키며, 해당 집합작용은 양자 간의 특이한 상호작용에 의존한다고 밝혔다. SAGA 복합물 중 USP22의 주요한 기능은 히스톤 H2B의 탈모노유비퀴틴화를 담당하기에 세포 중 히스톤 H2B의 모노유비퀴틴화 수준을 검출하여 PolyQ이 비정상적으로 확장된Ataxin-7이 SAGA 복합물의 기능에 미치는 영향을 추정할 수 있다. 연구 결과, PolyQ이 비정상적으로 확장된 Ataxin-7은 USP22의 탈유비퀴틴화 효소의 활성을 낮추고 세포 중 모노유비퀴틴화 H2B의 수준을 뚜렷하게 증가시켰는데, 이는Ataxin-7의 PolyQ 확장이 SAGA 복합물 중 USP22의 탈유비퀴틴화 기능을 손상시킨다는 것을 입증한다. 해당 연구는 SCA7 질환에 전사조절 장애가 나타나는 원인을 해석하였으며, SCA7 질환의 발병 메커니즘을 해석하는데 새로운 근거를 제공하였다. 정보출처 : http://www.sibs.cas.cn/xwdt/kyjz/201509/t20150906_4420804.html  |
- 정책동향
- 이슈리포트
- 통계DB
- 통계DB
